Bestimmung der Molaren Masse leicht
verdampfbarer Flüssigkeiten
(vereinfacht nach Victor Meyer)
Geeignet ist der Versuch für alle Flüssigkeiten, die bei
Zimmertemperatur relativ gut verdunsten.
Besonders gut geeignet sind z.B. Methanol, Pentan, Diethylether. Weniger gute
Werte erhält man mit Ethanol und Hexan. Hierzu sollte man die Molare Masse nach
der Methode von Victor Meyer bestimmen.
Versuchsaufbau und Durchführung:
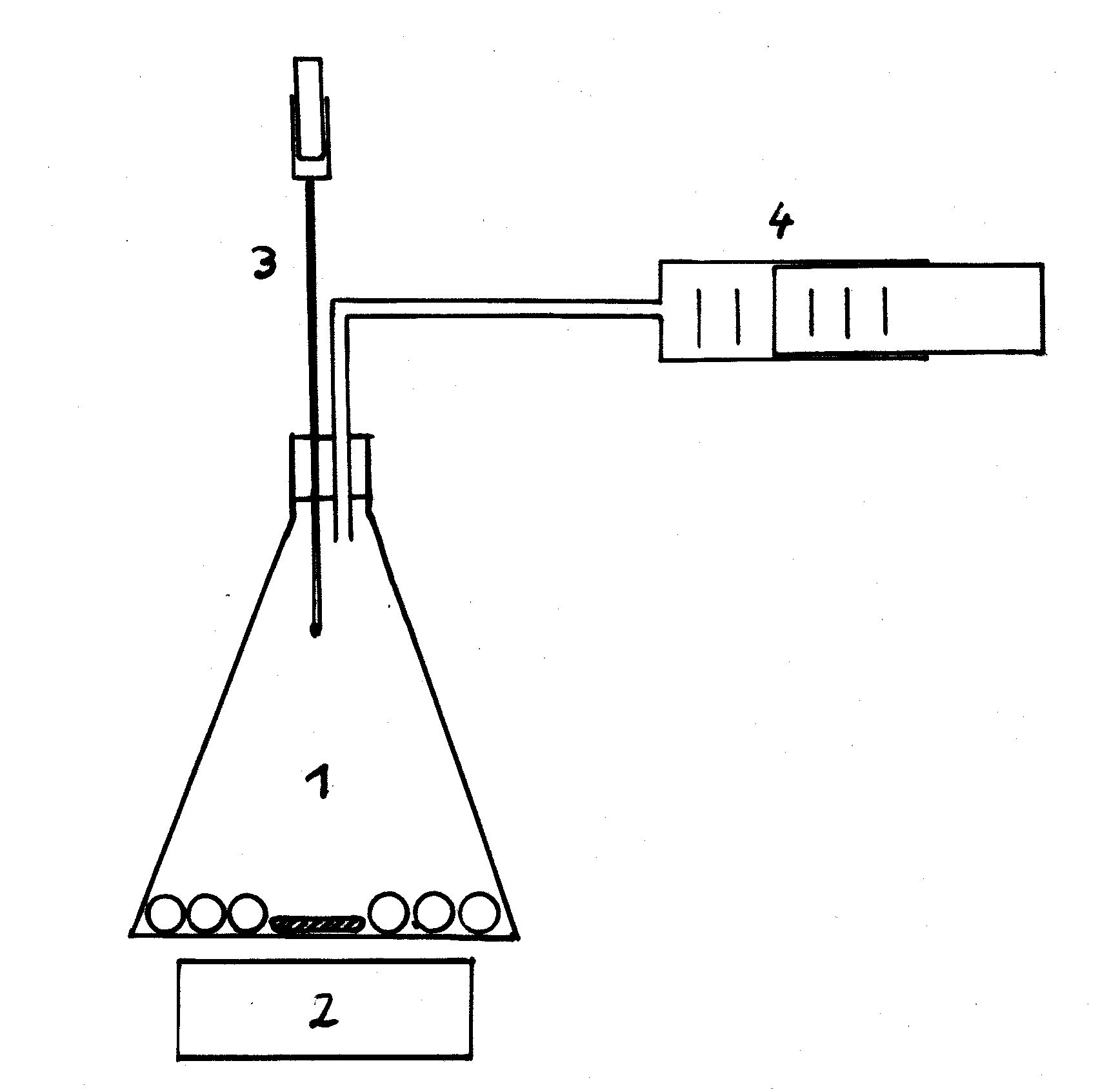
1: 1L-Kolben mit kleinen Glasperlen und Rührstab
2: Magnetrührer
3. Pipette (1 mL) mit aufgesetzter Spritze
4: Kolbenprober (100 mL oder 50 mL)
Die Pipette wird mit einem exakt abgemessenen Volumen der Flüssigkeit
gefüllt, deren Molare Masse bestimmt werden soll.
Danach wird die Apparatur auf Dichtigkeit geprüft.
Mit der Spritze wird die Flüssigkeit aus der Pipette vollständig in den
Kolben gedrückt und der Magnetrührer eingeschaltet. Dabei verdunstet die
Flüssigkeit, bedingt durch die Oberflächenvergrößerung durch die
Glasperlen, relativ schnell. Bewegt sich der Kolben des Kolbenprobers
nicht mehr, wird das Volumen abgelesen, das der verdampften Flüssigkeit
entspricht. |
 |
Versuchsauswertung: (Beispiel)
Angenommen wird Zimmertemperatur (20 oC) und Normaldruck.
Volumen der Flüssigkeit in der Pipette: V = 0,15 mL
Dichte der Flüssigkeit (zuvor bestimmt): D = 0,792 g/mL
Masse der Flüssigkeit: m = D *
V m = 0,12 g
Volumen des Gases (Kolbenprober) : Vg = 86
mL
Molares Volumen (Zimmertemperatur) : VM = 24 L/mol
Berechnung der Stoffmenge:
n = Vg / VM n = 0,086 L / 24
L * mol-1 = 0,0036 mol
Berechnung der Molaren Masse:
M = m / n M = 0,12 g / 0,0036 mol = 33,3 g / mol
Dies entspricht in etwa der Molaren Masse von Methanol (32 g / mol).
