Elementaranalyse
(nach Liebig)
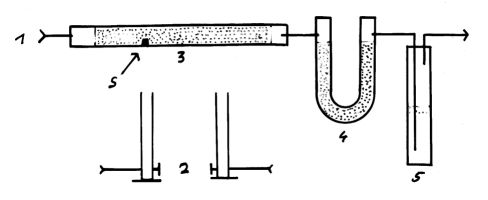
Versuchsaufbau und Durchführung:
1: Sauerstoffdruckflasche
2: Brenner
3: Reaktionsrohr (schwer schmelzbar)
mit Kupferoxid (gekörnt) und der organischen
Substanz (S)
4: U-Rohr mit getrocknetem Calciumchlorid (wasserfrei)
5: Waschflasche mit Kalilauge (30 %)
Die organische Substanz wird genau abgewogen (< 0,5 g). Das
Reaktionsrohr wird wie abgebildet gefüllt. U-Rohr (4) und Waschflache (5)
werden vor dem Versuch ebenfalls genau gewogen.
Durch die Apparatur wird der Sauerstoff in kleinem Strom geleitet. Dann
wird zunächst der rechte Teil des Reaktionsrohres erhitzt und danach der
linke Teil mit der organischen Substanz. Man erhitzt solange, bis keine
organische Substanz mehr erkennbar ist und das Kupferoxid wieder
gleichmäßig schwarz ist. Nach dem Versuch werden U-Rohr und Waschflasche
erneut gewogen. |
 |
Auswertung mit Beispiel:
Bei dem Versuch werden Kohlenstoff zu Kohlenstoffdioxid, das in der Kalilauge
absorbiert wird, und Wasserstoff zu Wasser, das im Calciumchlorid gebunden wird,
oxidiert.
Über die Massen von Kohlenstoffdioxid und Wasser werden die Massen und
Stoffmengen von Kohlenstoff und Wasserstoff in der Substanz berechnet. Die Masse
und Stoffmenge von Sauerstoff wird durch Differenzbildung berechnet.
m(C) = m(CO2) * M(C) / M(CO2) = m(CO2) * 12
/ 44
m(H) = m(H2O) * 2 * M(H) / M(H2O) = m(H2O) *
2 / 18
m(O) = m(Substanz) - m(C) - m(H)
n(C) = m(C) / M(C)
n(H) = m(H) / M(H)
n(O) = m(O) / M(O)
Beispiel Glucose:
Masse der
Substanz: m(Sub.) = 0,443 g
Masse Kohlenstoffdioxid: m(CO2) = 0,65 g
Masse
Wasser:
m(H2O) = 0,253 g
m(C) = 0,1773 g
m(H) = 0,0281 g
m(O) = 0,2376 g
n(C) = 0,01477
n(H) = 0,02810
n(O) = 0,01485
n(C) : n(H) : n(O) = 1,051 : 2 : 1,053
Zur Bestimmung der Verhältnisformel muss die Molare Masse der Substanz
bestimmte werden, z.B. über die Gefriertemperaturerniedrigung.
